Défaut de valve cardiaque congénitale: un type courant de malformation congénitale
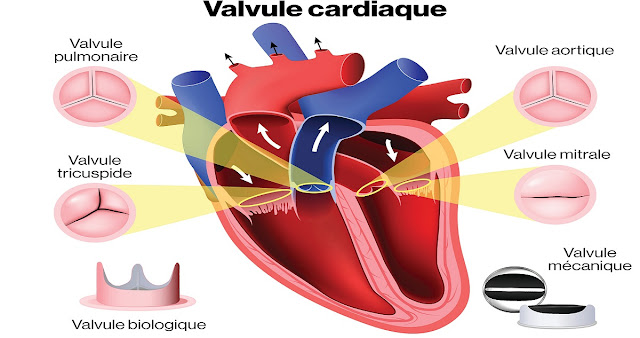
Les valves cardiaques veillent à ce que le cœur battant dirige le flux sanguin dans une direction. Comme le cœur bat continuellement au cours de la vie, le fonctionnement de la valve doit être sans faille. Les anomalies congénitales des valves cardiaques apparaissent dans 2% des naissances vivantes, ce qui en fait le type d'anomalie congénitale le plus courant.
Toute obstruction des flux aller ou retour due à une valve défectueuse peut entraîner une insuffisance cardiaque. Les défauts les plus graves de la valve sont traités chirurgicalement, la valve d'origine pouvant être réparée et d'autres fois, elle doit être remplacée. Cependant, en général, les enfants qui grandissent ont besoin de remplacer les valves rapidement pour éviter de trop grandir une valve remplacée trop tôt.
"Pour de nombreux bébés atteints de cardiopathie congénitale, leur état est un problème mineur qui ne nécessite aucun traitement ou qui peut être corrigé avec succès par la chirurgie.
"
Certains de ces défauts ont été liés à des mutations génétiques spécifiques, mais la majorité n’a pas de cause génétique clairement définissable, ce qui suggère que les facteurs épigénétiques - changements de l’expression des gènes versus modification du code génétique - jouent un rôle important. Des chercheurs de la Perelman School of Medicine de l'Université de Pennsylvanie ont découvert que la force, ou cisaillement, du flux sanguin contre les cellules bordant la valvule cardiaque précoce envoyait des signaux aux cellules du «coussin» cardiaque pour qu'elles deviennent des valvules complètement formées.
Les valves cardiaques embryonnaires développent de grands coussins qui, au cours du développement, se remodèlent et s'amincissent pour former des feuillets valvulaires matures. "La maturation de ces grands coussins moelleux dans les folioles parfaitement ajustées d'une valvule cardiaque mature est une merveille architecturale", a déclaré le principal auteur Mark Kahn, MD, professeur de médecine cardiovasculaire. "Nous avons montré que la signalisation par la protéine KLF2-Wnt sensible au cisaillement est à la base de ce remodelage.
"
Lauren Goddard, PhD, chercheuse postdoctorale au laboratoire Kahn, a découvert que la protéine KLF2 était exprimée par les cellules de détection du cisaillement qui tapissent les coussins de valves primitives. L'expression de KLF2 était la plus élevée dans les régions de la vanne qui subissent les forces de cisaillement les plus fortes. À l'aide de modèles murins, elle a constaté que la suppression de KLF2 dans ces cellules entraînait la formation de grands coussins dont la maturation n'était pas satisfaisante. Le profilage des gènes exprimés par les premières cellules du coussin cardiaque a révélé que la perte de KLF2 entraînait une diminution significative de l'expression du partenaire de liaison Wnt, WNT9B, une molécule importante dans la voie de communication de la maturation valvulaire.
La perte de WNT9B chez la souris a entraîné un remodelage défectueux de la vanne, semblable à ce qui se produit lorsque KLF2 est supprimé, ce qui suggère que c'est une cible clé en aval de KLF2. Les travaux de Julien Vermot, coauteur de l'Agence nationale de la recherche, spécialiste de la détermination du développement du poisson zèbre par les forces de cisaillement, ont démontré que l'expression du gène de WNT9B se limitait aux cellules qui régissent les valves cardiaques en développement et dépendait du cisaillement. force de la circulation sanguine précoce. Ces résultats ont permis de relier les forces de cisaillement à la signalisation KLF2-WNT9B lors du remodelage de la valve.
Ce travail est le premier à démontrer comment le flux sanguin façonne les valvules cardiaques en développement en feuilles de valvules matures. Selon les chercheurs, ces études prédisent que même une panne mineure de la série de communications cellule à cellule orchestrées avec précision, nécessaires pour transmettre avec précision les signaux provenant du flux sanguin, peut entraîner des vannes légèrement défectueuses. Cette idée soutient une explication épigénétique des défauts communs des valves congénitales.